Cálculo de Concentração das Soluções.
1. Numa determinada área
urbana, a concentração média do agente poluente SO2 no ar
atmosférico atingiu o valor de 3,2 x 10-4 g.m-3. Essa
concentração, expressa em mol.L-1 e em moléculas.m-3,
corresponde, respectivamente, aos valores
a) 5,0 x 10-6 e 3,0 x 1018.
b) 3,2 x 10-7 e 6,0 x
1020.
c) 5,0 x 10-9 e
2,7 x 1025.
d) 5,0 x 10-3 e 3,0 x 1021.
e) 5,0 x 10-9 e 3,0
x 1018.
.
2. Misturando-se
250 mL de solução 0,600 mol/L de KCℓ com 750 mL de solução 0,200 mol/L de BaCℓ2,
obtém-se uma solução cuja concentração de íon cloreto, em mol/L, é igual a:
a) 0,300 b) 0,400 c) 0,450 d) 0,600 e) 0,800.
3. O volume, em
mililitros, de uma solução de 0,5 mol/L de AgNO3 necessário
para preparar 200 mililitros de uma solução 0,1 mol/L desse sal é igual a
a) 10. b) 20. c) 25. d) 40. e) 50.
4. O soro
fisiológico é uma solução aquosa que contém 0,9 % em massa de NaCℓ. Para
preparar 200 mL dessa solução, a quantidade necessária de NaCℓ é de
aproximadamente:
a) 0,45 g. b) 1,8 g. c) 0,09 mol. d)
0,18 mol. e) 10,6
g.
5. Um técnico
laboratorial, distraidamente, deixou derramar no chão um frasco de 20 mL de uma
solução 0,2 mol/L de ácido sulfúrico. Na prateleira, ele dispunha de uma
solução de hidróxido de sódio 0,6 mol/L. Nessa situação, para neutralizar
completamente o volume de ácido derramado, será necessário um volume de base
igual a:
a) 18,50 mL b) 20,00 mL c) 6,66 mL d) 13,33 mL e) 26,66 mL
6. Antigamente, o açúcar
era um produto de preço elevado e utilizado quase exclusivamente como
medicamento calmante. No século XVIII, com a expansão das lavouras de
cana-de-açúcar, esse cenário mudou. Hoje, a sacarose é acessível à maior parte
da população, sendo utilizada no preparo de alimentos e bebidas. Um suco de
fruta concentrado de determinada marca foi adoçado com 3,42 g de açúcar
(sacarose: C12H22O11) em 200 mL de solução.
Com este suco, foi preparado um refresco, adicionando-se mais 800 mL de água. A
concentração em mol/L de sacarose no suco e a concentração em g/L de sacarose
no refresco são, respectivamente
a) 0,05 e 34,2
b) 0,05 e 3,42
c) 0,5 e 3,42
d) 0,5 e 34,2
e) 0,05 e 342
7. Os licores são
constituídos principalmente de extrato de plantas, álcool etílico e uma grande
quantidade de água e sacarose. Num copo de Becker, foram misturados 400 mL de
solução de sacarose de concentração 57 g/L com 600 mL de solução de
concentração 19 g/L do mesmo açúcar. A concentração da sacarose (C12H22O11)
em mol L-1, na solução final é, aproximadamente,
a) 0,10 b) 0,34 c) 1,00 d) 3,42 e) 34,20
8. O atleta Michael
Phelps é considerado um fenômeno na natação. Contribui para esse sucesso uma
particularidade metabólica que lhe confere uma recuperação fora do comum.
Enquanto a maior parte dos nadadores, depois das competições, apresenta uma média
de 10 milimols de ácido lático por litro de sangue, o nadador campeão apresenta
apenas 5,6 milimols.
Fonte: Veja, n.
2073, p.122, 13 ago. 2008.
As concentrações de ácido lático (C3H6O3),
em gramas por litro de sangue, que correspondem, respectivamente, a 10
milimols/L e 5,6 milimols/L, são de aproximadamente
a) 1 x 10-1 e 5,6 x 10-1 . b) 1 x 10-3 e 5,6 x 10-3. c) 4,5 x 10-1 e 2,5 x
10-1.
d) 9 x 10-1 e 5 x 10-1 . e) 9 x 10-3 e 5 x 10-3.
9. A mistura de 26,7 g de
NaCℓ (massa molar 53,4 g.mol-1) em água suficiente para que a solução apresente
o volume de 500 mL resulta numa concentração de:
a) 26,7% (m/v). b) 26,7 g.L-1. c) 1,0 mol.L-1. d) 0,0534 g.L-1. e) 13,35 L.mol.
10. Durante a temporada
de verão, um veranista interessado em química fez uma análise da água da Praia
Mansa de Caiobá. Pôs para evaporar ao ar livre 200 mL de água dessa praia, e o
material sólido resultante ele colocou no forno de sua casa, ligado a 180 °C,
por algumas horas. Ao pesar o material resultante, ele encontrou 6 gramas de
sólido como resultado. Supondo que o material encontrado pelo veranista era
NaCℓ (59 g/mol), assinale a alternativa que apresenta a concentração desse sal
na água do mar em mol/L.
a) 0,5. b) 1. c) 3,4. d) 0,2. e) 0,1.
Gabarito
1[E] 2[C]
3[D] 4[B] 5[D] 6[B] 7[A] 8[D] 9[C]
10[A]
1) Sabemos que o analgésico sintetizado por A. Bayer tem a
fórmula estrutural mostrada a seguir:
em relação à constituição deste composto, qual das opções a seguir
contém a afirmação ERRADA?
Este composto contém:
a) Um grupo
carboxila. b) Um anel
aromático e um grupo carboxila.
c) Um grupo éter e um anel
aromático. d) Um
grupo éster e um grupo carboxila.
e) Um anel aromático, um grupo
éster e um grupo carboxila.
2) A fórmula molecular C2H6O pode
representar compostos pertencentes às funções
(A) hidrocarboneto, álcool e
aldeído. (B) álcool
e éter. (C) aldeído
e cetona.
(D) ácido carboxílico, aldeído e
álcool. (E) éter,
cetona e éster.
3) Na análise de uma amostra de manteiga rançosa, foram encontrados
compostos com fórmulas moleculares C3H6O e C4H8O2.
Sabendo-se que esses compostos apresentam cadeias carbônicas acíclicas, normais
e saturadas, é possível prever que se trata de
(A) aldeídos, cetonas e ácidos
carboxílicos. (B) aldeídos,
álcoois e éteres.
(C) álcoois, éteres e
ésteres. (D) ácidos
carboxílicos, cetonas e álcoois.
(E) ésteres, aldeídos e
éteres.
4) O ortocresol, presente na creolina, resulta da substituição de
um átomo de hidrogênio do hidroxibenzeno por um radical metila. A fórmula
molecular do ortocresol é
(A) C7H8O (B) C7H9O (C) C6H7O (D) C6H8O (E) C6H9O
5) Na reação de esterificação, os nomes dos compostos I, II e III
são, respectivamente,
a) ácido
etanoico, propanal e metanoato de isopropila.
b) etanal,
propanol-1 e propanoato de etila.
c) ácido
etanoico, propanol-1, etanoato de n-propila.
d) etanal,
ácido propanoico, metanoato de n-propila.
e) ácido
metanoico, propanal e etanoato de n-propila.
6) Assinale a alternativa que apresenta a associação correta
entre a fórmula molecular, o nome e uma aplicação do respectivo composto
orgânico.
a) CH3COOCH2CH3 -
acetato de butila - aroma artificial de fruta
b) CH3CH2OCH2CH3 -
etoxietano - anestésico
c) CH3CH2COCH3 -
propanona - removedor de esmalte
d) CH3CH2COOH
- ácido butanoico - produção de vinagre
e) CH3CH2CH2CH2CH3 -
pentano - preparação de sabão
7) Entre as muitas drogas utilizadas no tratamento da AIDS,
destaca-se o flavopiridol (estrutura a seguir), que é capaz de impedir a
atuação da enzima de transcrição no processo de replicação viral.Nessa molécula estão presentes as funções orgânicas
a) amina, éster, cetona e
fenol.
b) amina, éter, halogeneto de
arila e álcool.
c) éster, cetona, halogeneto de
arila e álcool.
d) éter, amina, halogeneto de
alquila e fenol.
e) éter, halogeneto de arila,
fenol e cetona.
8) Em meio fortemente ácido (pH<1 alternativa:="" amino="" apresentar-se-="" asp="" cido="" dada="" essencial="" forma="" na="" o="" rtico="" span="">

9) Os LCDs são mostradores
de cristal líquido que contêm em sua composição misturas de substâncias
orgânicas. A substância DCH-2F é um cristal líquido nemático utilizado na
construção de mostradores de matriz ativa de cristais líquidos. Sua estrutura
está representada a seguir.
A substância DCH-2F é um
(A) isocianeto
aromático. (B) cianeto
aromático. (C) haleto orgânico.
(D) alcano saturado. (E) hidrocarboneto
aromático.
10) A seguir estão relacionados, os nomes químicos de seis
compostos orgânicos e, entre parênteses, suas respectivas aplicações; e adiante
na figura, as fórmulas químicas de cinco desses compostos.
Associe-os adequadamente.
1 - ácido ρ-aminobenzoico (matéria-prima de síntese do anestésico
novocaína)
2 - ciclopentanol (solvente orgânico)
3 - 4-hidróxi-3-metoxibenzaldeído (sabor artificial de baunilha)
4 - α-naftol (matéria-prima para o inseticida carbaril)
5 - trans-1-amino-2-fenilciclopropano (antidepressivo)
6 - β-naftol (conservante de alimentos)
A sequência correta de preenchimento dos parênteses, de cima para baixo,
é
(A) 1 - 5 - 6 - 3 -
2.
(B) 5 - 3 - 6 - 2 -
4.
(C) 1 - 4 - 3 - 5 -
2.
(D) 1 - 5 - 4 - 3 -
2.
(E) 3 - 2 - 4 - 1 -
6.
11) Em 1998, o lançamento de um
remédio para disfunção erétil causou revolução no tratamento para impotência. O
medicamento em questão era o Viagra®. O princípio ativo dessa droga é o citrato
de sildenafil, cuja estrutura é representada na figura:
funções orgânicas I e II, circuladas na
estrutura do citrato de sildenafil, são
(A) cetona e amina.
B) cetona e amida. C) éter e amina. (D) éter e amida. (E) éster e amida.
12) O aspartame, estrutura representada
a seguir, é uma substância que tem sabor doce ao paladar. Pequenas
quantidades dessa substância são suficientes para causar a doçura aos
alimentos preparados, já que esta é cerca de duzentas vezes mais doce do
que a sacarose.

As funções orgânicas presentes na molécula desse adoçante são, apenas,
a) éter, amida, amina e cetona.
b) éter, amida, amina e ácido carboxílico.
c) aldeído, amida, amina e ácido carboxílico.
d) éster, amida, amina e cetona.
e) éster, amida, amina e ácido carboxílico.
|
|
13)A
aspoxicilina, , abaixo
representada, é uma substância utilizada no tratamento de infecções
bacterianas. As funções 1, 2, 3 e 4 marcadas na estrutura são,
respectivamente:
(A) amida, fenol, amina, ácido
carboxílico. (B) amida,
amina, álcool, éster.
(C) amina, fenol, amida, aldeído. (D) amina, álcool,
nitrila, ácido carboxílico.
(E) amida, nitrila, fenol, éster.
14) O composto antibacteriano ácido
oxalínico é representado pela fórmula estrutural:
e apresenta as seguintes funções:
a) éster, cetona, amina e éter b) éter, cetona,
amina e ácido carboxílico
c) éster, amida, amina e ácido
carboxílico d) éster, amina,
fenol e cetona
e) éter, amida, éster e amina
|
15) Os
xampus, muito utilizados para limpar e embelezar os cabelos, de modo geral,
contêm em sua constituição, no mínimo, as seguintes
substâncias: detergente, corante, bactericida, essência e ácido cítrico |
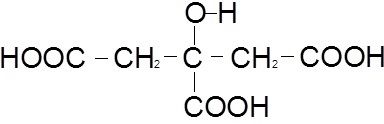
As funções orgânicas, presentes na fórmula estrutural do ácido mencionado, são:
a) cetona e álcool b) álcool e aldeído c) ácido carboxílico e álcool d) ácido carboxílico e aldeído e) cetona e éster
16.) Observe a estrutura da muscona abaixo. Esta substância é utilizada em
indústrias farmacêuticas, alimentícias e cosméticas, tendo sua maior
aplicação em perfumaria. É o princípio ativo de uma
secreção glandular externa produzida por uma espécie de veado que habita
a Ásia Central: os almiscareiros . Os machos dessa
espécie produzem a muscona (almíscar), com a finalidade de
atrair as fêmeas na época do acasalamento. Em perfumaria, a sua principal
aplicação é como fixador de essências.
Marque
a alternativa que corresponde à função orgânica que caracteriza a
muscona:
A) Ácido carboxílico B) Aldeído c)Cetona (D) Éter (E) Fenol
17)
O acebutolol pertence a
uma classe de fármacos utilizada no tratamento da hipertensão.Estão
presentes na estrutura do acebutolol as seguintes funções:
a) éster, álcool, amina, amida,
alqueno. b) amida, alqueno, álcool, amina,
fenol.
c) amina, fenol, aldeído, éter,
álcool. d) cetona, álcool, amida, amina,
alqueno.
e) amida, cetona, éter, álcool,
amina.
18) Associe os nomes comerciais de
alguns compostos orgânicos e suas fórmulas condensadas na coluna de cima com os
nomes oficiais na coluna de baixo.
|
A
associação correta entre as duas colunas é
(P)
Propanotriol
(Q)
Ácido etanóico
(R)
Metanal
(S)
Fenil amina
(T)
Etino
|
|
I. Formol (CH2O)
II. Acetileno
III. Vinagre (CH3 – COOH)
IV. Glicerina (CH2OH – CHOH – CH2OH)
a) I-P, II-T, II-Q,
IV-R
b) I-Q, II-R, II-T, IV-P
c) I-Q, II-T, III-P, IV-R
d) I-R, II-T, III-Q, IV-P
e) I-S, II-R, III-P, IV-Q
19) Sobre os compostos:
I. H2C = CH - CONH2
II. CH3 - CH2 - CHO
III. H2C = CH - NH - CH2 - CH3
IV. 2ON - O - CH2 - CH3
V. CH3 - CH2 - CH2OH
São
feitas as afirmações abaixo. Assinale a única falsa:
a) I é
amida
b) IV é
nitrocomposto
c) V é
álcool
d) II é
aldeído
e) III é
amina
|
|
20) Considere as seguintes
substâncias:
e as seguintes funções químicas:
a. ácido carboxílico; b. álcool; c. aldeído; d. cetona; e. éster; f. éter.
A opção que associa CORRETAMENTE as substâncias
com as funções químicas é
a) Id;
IIc; IIIe; IVf.
b) Ic; IId; IIIe; IVa.
c) Ic;
IId; IIIf; IVe.
d) Id; IIc; IIIf; IVe.
e) Ia; IIc; IIIe; IVd.
21) O efeito destrutivo dos CFC sobre a
camada de ozônio tem sido matéria muito discutida ultimamente. A sigla CFC
designa um grupo de compostos formados por carbono, flúor e cloro, usados em
aerossóis e refrigeração. O mais usado, o freon -12, apresenta fórmula
molecular CF2Cl2. Em relação às funções orgânicas, o
freon -12 é um :
a) hidrocarboneto
b) haleto
c) fenol
d) aldeído
e) cloreto de ácido
22) Considere:
I. H2C = CH - CH2OH
II. H3C
- CO - CH = CH2
III.H3C
- O - CH2 - CH = CH2
Os compostos I, II, III são
respectivamente exemplos de
a) hidrocarboneto, éter,
cetona.
b) álcool, cetona, éter.
c) hidrocarboneto, cetona,
éster.
d) álcool, éster,
hidrocarboneto.
e) hidrocarboneto, éster,
éter.
23) Sabemos que o analgésico sintetizado por A.
Bayer tem a fórmula estrutural mostrado abaixo:
Em relação à constituição deste
composto, qual das opções abaixo contém a afirmação ERRADA? Este composto
contém
a) Um grupo carboxila.
b) Um anel aromático
e um grupo carboxila.
c) Um grupo éter e um anel
aromático.
d) Um grupo éster e um
grupo carboxila.
e) Um anel aromático, um
grupo éster e um grupo carboxila.
24) Os compostos a seguir são, respectivamente:
I.
CH3 - CH2 -
COH
II.
CH3 – CH2 - CH3
II.
CH3 – CH2 – COOH
a) aldeído, hidrocarboneto, ácido
carboxílico
b) ácido carboxílico,
hidrocarboneto, aldeído
c) ácido carboxílico, aldeído,
hidrocarboneto
d) álcool, hidrocarboneto, ácido
carboxílico
e) hidrocarboneto, cetona,
aldeído
25)“Sem a química o Natal seria muito
diferente. (...) Será que Papai Noel teria presentes suficientes, em quantidade
e diversidade, se a química não tivesse desenvolvido produtos como o náilon?”
(Informativo CRQ – XII, dez/ 2002). O náilon é fabricado com base na reação
entre um ácido dicarboxílico com uma diamina, que forma uma estrutura como a
representada a seguir:
A função orgânica assinalada é chamada
a) amida
b) amina
c)
éster
d)
éter
e) cetona
GABARITO:
1C - 2B - 3A - 4A - 5C - 6B - 7E - 8C - 9C- 10D- 11C - 12E - 13A - 14B - 15C -16C - 17E - 18 D
-19B – 20C – 21B – 22B – 23C – 24A – 25A





 As funções orgânicas, presentes na fórmula estrutural do ácido mencionado, são:
As funções orgânicas, presentes na fórmula estrutural do ácido mencionado, são:





